 |
|
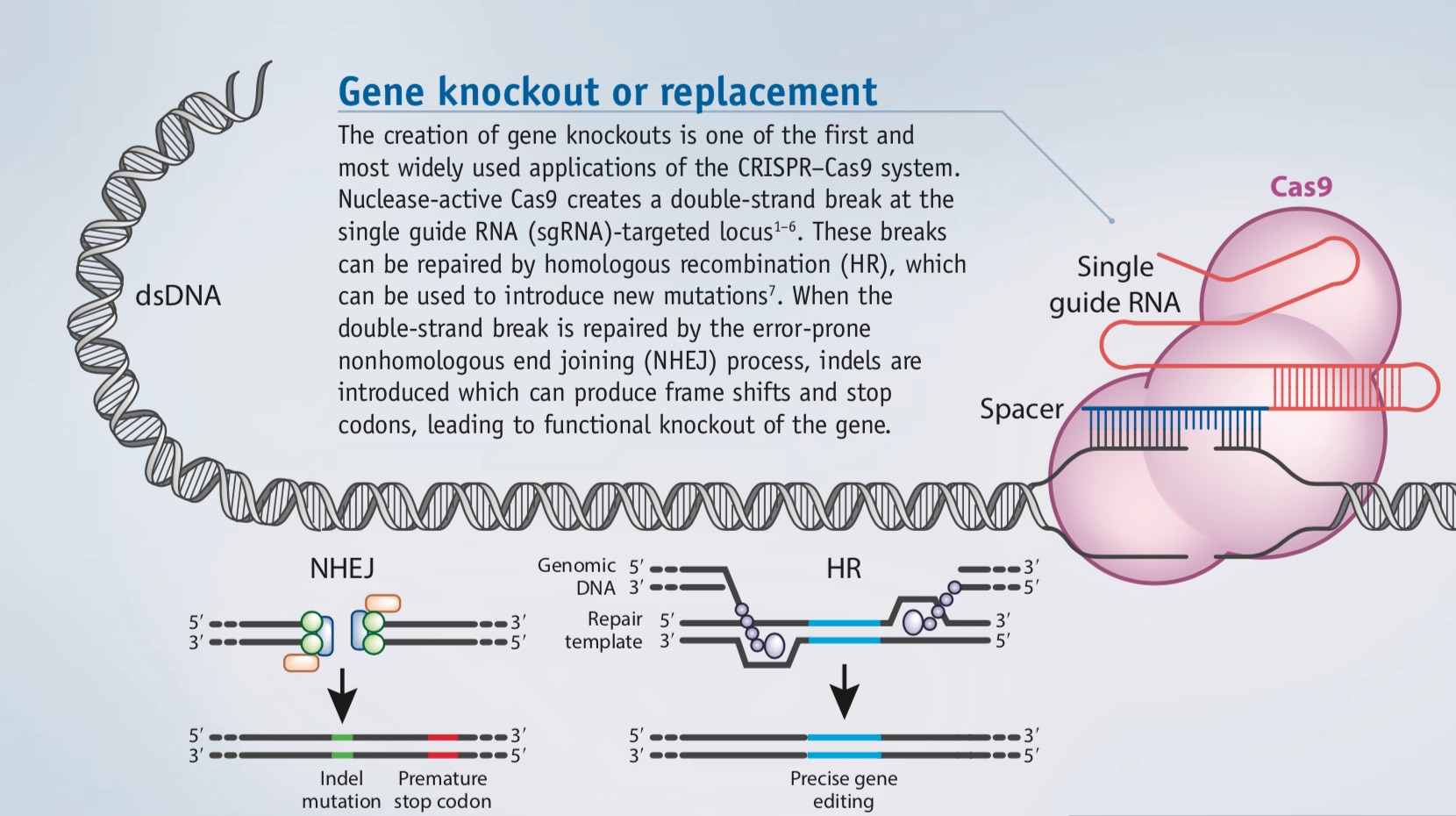
Utilizzo della tecnica CRISPR per il silenziamento o la sostituzione di geni, ripreso da: Expanding the CRISPR Toolbox. |
CRISPR: la rivoluzione continua
Cari ragazzi è tempo di parlare di nuovo di CRISPR, la tecnica di biologia molecolare che, dal 2012, permette di variare il genoma praticamente
di tutti gli organismi con estrema rapidità, precisione e semplicità
(leggi anche CRISPR: è rivoluzione in biologia molecolare).
La tecnica sfrutta un sistema batterico di difesa contro le infezioni virali. Se un virus infetta una cellula batterica iniettando il suo DNA (o RNA), questo
viene "memorizzato" e conservato in copia all'interno del genoma, vicino ad una sequenza che codifica per una endonucleasi, che si chiama CAS.
CAS è un enzima che digerisce il DNA, così quando il virus infetta la cellula, CAS viene trascritto e tradotto in proteina e il genoma virale
da digerire copiato in RNA. L'RNA si appaia al DNA virale complementare,
in questo modo riconoscendolo. Il genoma virale viene quindi digerito e l'infezione evitata.
I biologi molecolari hanno saputo sfruttare questo sistema per mettere a tacere un gene o sostituirlo
(gene knockout or replacement), per regolare la trascrizione genica (transcriptional regulation), per modificare
le variazioni epigenetiche (epigenome editing,
leggi anche Tutti pazzi per l'epigenoma), per variare singole basi del DNA (base editing) e addirittura per costruire
sonde fluorescenti (CRISPR imaging).
Il motivo per cui questa tecnica è così potente risiede nella presenza dell'RNA guida. L'endonculeasi CAS viene letteralmente guidata dalla
molecola di RNA, ad essa associata, nella ricerca della sequenza da mutare, silenziare o sostituire. Cerchiamo di capire come tutto ciò avviene a
livello molecolare.
Gene knockout or Replacement. Una delle prime applicazioni di questa tecnica è stata quella di
modificare o sostituire un gene. Supponiamo di avere un gene mutato che provoca una malattia. Si associa alla proteina CAS l'RNA corrispondente al
gene da modificare, correggendo però la sequenza. CAS troverà il gene mutato, lo eliminerà digerendolo e al posto della sequenza
sbagliata introdurrà quella corretta. Nel caso in cui il gene debba essere silenziato, viene introdotta una tripletta di "stop" della
traduzione, così la proteina corrispondente non viene prodotta.
Transcriptional regulation. La proteina CAS può essere fusa anche con il complesso proteico che regola
l'espressione genica. In questo caso, il sistema molecolare riconosce il gene da attivare o silenziare e stimola o blocca la sua espressione
a seconda delle necessità. Per esempio, un gene che se espresso può portare allo sviluppo del cancro o alla sua progressione
può in questo modo essere bloccato.
Epigenome editing. La regolazione dell'espressione dei geni nei vari tessuti e in momenti diversi
della vita di una cellula dipende
anche dalle modifiche epigenetiche, come per esempio la metilazione di alcune basi del DNA.
Ebbene, la tecnica CRISPR si è dimostrata così
versatile da poter agire anche sulla metilazione del DNA e quindi può essere programmato anche un cambiamento dell'epigenoma.
Base editing. La tecnica CRISPR è stata ottimizzata in questi cinque anni dopo la sua scoperta
in modo tale da poter mutare singole basi con estrema precisione ed efficienza.
Questo l'ha resa adatta a costruire popolazioni di mutanti utili per studiare nuovi
fenotipi.
CRISPR imaging. CAS è stata fusa anche con alcune proteine fluorescenti e questo ha
permesso di usare la tecnica per localizzare i geni sui cromosomi come se avessimo una lampadina che si accende nella
posizione cromosomica in cui si trova il gene di interesse.
 |
|
Utilizzo della tecnica CRISPR per il silenziamento o la sostituzione di geni, ripreso da: Expanding the CRISPR Toolbox. |
È chiaro che le applicazioni del CRISPR sono innumerevoli e i risultati scientifici ottenuti con questa tecnica sono impressionanti. Facciamo
due esempi significativi. Nel campo della biologia vegetale, la coltura intensiva di alcune varietà di piante
ottenute mediante la selezione artificiale ha eroso la biodiversità di queste specie. Basti pensare alle varietà coltivate di cereali o di
piante da frutto. Le varietà coltivate sono diventate più suscettibili ai patogeni, mentre le specie selvatiche, imparentate con quelle coltivate,
hanno mantenuto una più elevata diversità genetica.
Dalle specie selvatiche è quindi possibile recuperare gli alleli responsabili della
resistenza a determinati patogeni, alla siccità e così via e trasferirli nel genoma delle piante coltivate per rafforzarle dal punto di vista
genetico. Oggi grazie al CRISPR tutto questo è molto facile da realizzare.
L'applicazione del CRISPR che più ha fatto notizia nel 2017 è legata però alla biologia umana. Per la prima volta un gene mutato
è stato modificato in un embrione umano. L'esperimento, realizzato negli USA, è stato condotto per correggere il gene responsabile della
cardiomiopatia ipertrofica che determina un'insufficienza cardiaca cronica. Il gene mutato è stato corretto in diversi embrioni trattati con la
tecnica CRISPR. Gli embrioni hanno evidenziato uno sviluppo normale nella fase di blastocisti e il difetto genetico che avrebbe provocato la malattia è
risultato corretto. Gli embrioni erano quindi pronti per essere impiantati. Tuttavia, sono stati poi distrutti. Infatti, non è
ancora permesso impiantare embrioni nell'utero di una donna che siano stati modificati geneticamente.
È chiaro che una tecnica di questo tipo impone serie riflessioni di carattere etico, ma resta senza dubbio la strada più promettente per la cura
di molte malattie genetiche, oltre che un potentissimo strumento di indagine scientifica. Se in futuro vorrete studiare biologia molecolare,
non dimenticate l'acronimo CRISPR =
Clustered Regularly Interspaced Short Palindromic Repeats!
Manuela Casasoli (manuela_casasoli@yahoo.it)